
Гжельский Государственный Университет продемонстрировал свои разработки на выставке «Архимед 2023»

Ритейлер «Лента» решил заняться ресторанным бизнесом
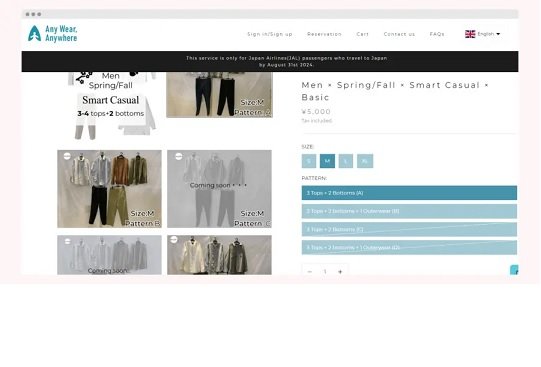
Японский авиаперевозчик начал предлагать путешественникам одежду в аренду

Спрос на услугу «пробива» абонента увеличился в 1,5 раза

Гай Ричи снимет фильм на деньги «Кинопоиска»

GS Group запустит в России контрактное производство электроники

Ant Group получила штраф от Народного банка КНР на 984 млн USD

Российские авиаперевозчики начали выполнять рейсы на Кубу

В России подешевели электросамокаты и моноколеса
Основные этапы регистрации лекарственных препаратов

Регистрация любого медикамента является неотъемлемой частью его производства и последующей реализации, а также необходимым условием для того, чтобы на законных основаниях ввести препарат в Гражданский оборот. Регистрации подлежат только лекарственные средства оригинального происхождения либо воспроизведенные. Дополнительно могут быть зарегистрированы комбинации ЛС, изготовленные в новом исполнении, либо те препараты, которые ранее регистрировались, но были выпущены в новой дозировке или форме.
На территорию Российской Федерации не может быть завезено ни одно лекарственное средство, если оно предварительно не подлежало регистрации в установленном порядке, о чем можно узнать более подробно на https://www.oct-clinicaltrials.com/ru/services/drug_registration_russia.php.
Те медикаменты, которые изготавливаются в аптеках в соответствии с рецептами, предоставленными врачами, не подлежат государственной регистрации. Данный документ действует на протяжении пяти лет, после чего возможно повторное прохождение процедуры. Подать заявку на перерегистрацию можно за три месяца до истечения установленного срока. Тот препарат, который прошёл все необходимые процедуры, вносится в Госреестр лекарственных средств и считается разрешенным к применению на территории РФ на весь период действия соответствующей документации.
Весь процесс регистрации лекарственного препарата состоит из пяти этапов.
На первом проводятся особые доклинические испытания, а также подготавливаются документы регистрационного досье и клинических исследований. Далее организуется фармацевтическая разработка с выпуском опытных серий и последующим вводом полученных образцов на территорию РФ.
Второй этап подразумевает подачу регистрационного досье в Минздрав РФ для получения разрешения на выполнение работ в рамках клинического исследования. Данный процесс обычно занимает около четырех месяцев.
Третий этап включает в себя непосредственно проведение клинических испытаний, где большее количество работ выполняется при взаимодействии со специальными исследовательскими центрами, а также страховыми и логистическими компаниями, без присутствия которых регистрация лекарств невозможна.
На четвёртом этапе полученные документы передаются в Минздрав РФ для проведения последующих экспертиз качества и выявления соотношения риска и пользы. На выполнение всех работ обычно уходит около полугода. Именно на данном этапе осуществляется фармацевтическая экспертиза имеющихся образцов.
Пятый этап считается завершающим и подразумевает оформление Минздравом РФ регистрационного удостоверения, являющегося разрешительным документов на присутствие нового медикамента на отечественном рынке.





